无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
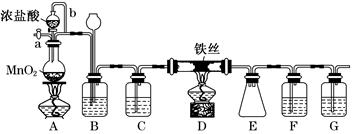
请回答:
(1)装置A中反应的离子方程式为__________________________________________。
(2)装置F中所加的试剂为_________________________________________________。
(3)导管b的作用为_____________________________________________________;
装置B的作用为________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为_______________________________________________________。
(5)反应结束后,拆卸装置前,必须进行的操作是_________________________________
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________(填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液
(1)MnO2+4H++2Cl-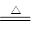 Mn2++Cl2↑+2H2O (2)浓硫酸或浓H2SO4 (3)平衡压强(或使浓盐酸顺利流下) 除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞 (4)排尽实验装置中的空气
Mn2++Cl2↑+2H2O (2)浓硫酸或浓H2SO4 (3)平衡压强(或使浓盐酸顺利流下) 除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞 (4)排尽实验装置中的空气
(5)打开活塞a,通入空气,排出装置内残留的Cl2,保证吸收更彻底(其他合理答案均可) (6)③
(1)MnO2与浓盐酸反应的离子方程式为MnO2+4H++2Cl-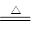 Mn2++Cl2↑+2H2O。(2)F装置用于防止产物水解,所以F中盛放浓硫酸。(3)导管b的作用是平衡压强,使浓盐酸顺利流下;装置B的作用是除去Cl2中的HCl气体,同时判断实验过程中导管是否被产品堵塞。(4)装置中的空气会影响产品的纯度,所以点燃D处的酒精灯前必须排尽实验装置中的空气。(5)氯气有毒,在拆卸装置前必须被完全吸收。(6)可用酸性高锰酸钾溶液检验亚铁离子。
Mn2++Cl2↑+2H2O。(2)F装置用于防止产物水解,所以F中盛放浓硫酸。(3)导管b的作用是平衡压强,使浓盐酸顺利流下;装置B的作用是除去Cl2中的HCl气体,同时判断实验过程中导管是否被产品堵塞。(4)装置中的空气会影响产品的纯度,所以点燃D处的酒精灯前必须排尽实验装置中的空气。(5)氯气有毒,在拆卸装置前必须被完全吸收。(6)可用酸性高锰酸钾溶液检验亚铁离子。
