实验室用足量MnO2与浓盐酸反应制取氯气,其装置如图1所示:
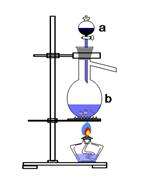

图1 图2
(1)图1中仪器a的名称是: ;仪器b的名称是: ;b中加入碎瓷片的作用是: 。
(2)请写出仪器b中发生的反应的离子方程式:
(3)检查装置的气密性之后的操作依次是: 、 、 。(填序号)
A.向烧瓶中加入MnO2粉末
B.加热
C.向烧瓶中加入浓盐酸
(4)该反应会因为盐酸浓度下降而停止。为了测定反应残留液中盐酸的浓度,某探究小组提出下列实验方案:
①甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量。
②乙同学的方案为:与足量的锌反应,测量生成气体的体积,实验装置如图2所示(夹持装置已略去)。使Y形管中的残留溶液与锌粒反应的正确操作是 (“锌粒转移到残留溶液中”或“残留溶液转移到锌粒中”)。在正确读取量气管读数时,视线要平视,要注意使漏斗液面与量气管中液面相平,除此外还须注意: 。
两种方案我认为 (填甲或乙)同学的方案可行。
(1)分液漏斗; 蒸馏烧瓶; 防止液体暴沸
(2)MnO2+4H++2Cl-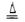 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
(3)A、C、B
(4)锌粒转移至残留溶液中; 恢复至室温; 乙
题目分析:图1装置有分液漏斗和蒸馏烧瓶组装而成,加入碎瓷片防止爆沸,检验气密性后,先加入固体,再加液体,最后加热,自下而上,MnO2+4H++2Cl-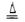 Mn2++2H2O+Cl2↑,盐酸表现还原性和酸性,甲同学检验的是氯离子的量,包括的除了剩余的盐酸,还有表现酸性的盐酸,也就是氯化锰的氯离子。乙同学把锌粒转入盐酸中,保证盐酸完全反应,准确测定盐酸的量,量气管读数时注意:1、回复至室温,2、调节液面相平,3、视线与凹液面相切。
Mn2++2H2O+Cl2↑,盐酸表现还原性和酸性,甲同学检验的是氯离子的量,包括的除了剩余的盐酸,还有表现酸性的盐酸,也就是氯化锰的氯离子。乙同学把锌粒转入盐酸中,保证盐酸完全反应,准确测定盐酸的量,量气管读数时注意:1、回复至室温,2、调节液面相平,3、视线与凹液面相切。
