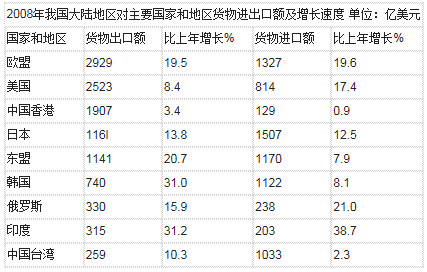
问题
问答题
(A组)将氯化镁和硫酸镁固体混合物20克溶解于100克水中,再加入100克一定浓度的氯化钡溶液恰好完全反应.过滤后将沉淀物洗净、烘干,称量为23.3克.试计算:
(1)原固体混合物中硫酸镁的质量百分含量.
(2)所得滤液的质量百分比浓度(精确到0.1%).
答案
(1)设参加反应硫酸镁的质量为x,生成氯化镁的质量为y.
BaCl2+MgSO4=BaSO4↓+MgCl2
120 233 95
x 23.3g y
=120 x
=233 23.3g 95 y
解之得:
x=12g,y=9.5g,
原固体混合物中硫酸镁的质量百分含量为:
×100%=60%12g 20g
(2)滤液中溶质的质量:(20g-12g)+9.5g=17.5g
滤液中溶质的质量分数:
×100%=8.9%17.5g 100g+20g+100g-23.3g
答:(1)原固体混合物中硫酸镁的质量百分含量为60%
(2)滤液的质量百分比浓度8.9%