三大强酸的性质均与浓度有关。回答下列问题:
(1)某学习小组用15 mol/L浓硝酸配制100 mL3 mol/L稀硝酸。
①他们需要用量筒量取15 mol/L浓硝酸_______mL;
②如下图所示仪器,在配制过程中不需用的是_________(填序号)。
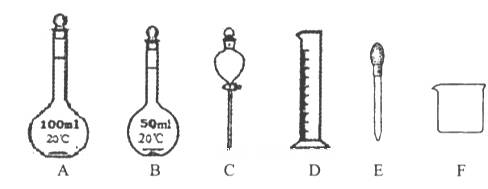
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是___________;
③下列实验操作中,不正确的是_________(填写标号)。
A.使用容量瓶前,检查它是否漏水。
B.定容时液面超过刻度线,多出的液体应用胶头滴管吸出。
C.配制溶液时,用量筒量取浓硝酸直接倒入容量瓶中,然后加蒸馏水定容。
D.定容后盖好瓶塞,把容量瓶反复上下颠倒,摇匀。④用量筒量取浓硝酸,读数时,俯视量筒,所配制溶液的浓度_________(填“偏高、偏低、无影响”)。
(2)①铜与浓硫酸在加热条件下反应,浓硫酸表现出来的性质是___________。
②MnO2与浓盐酸在加热条件下反应,离子方程式为__________。
③分别用浓硝酸和稀硝酸制取相同质量Cu(NO3)2晶体,消耗浓硝酸和稀硝酸的物质的量之比是__________。
(1)①20.0mL ②BC 玻璃棒 ③BC ④偏低
(2)①强氧化性和酸性 ②2Cl- + 4H+ + MnO2 Mn2+ + Cl2↑+ 2H2O ③3:2
Mn2+ + Cl2↑+ 2H2O ③3:2
题目分析:(1)本小题考查一定物质的量浓度溶液的配制。①根据稀释定律c1V1=c2V2计算;设所需浓硝酸的体积为x,15 mol/Lx="100" mL×3 mol/L,解得x=20.0mL;②一定物质的量浓度溶液的配制的步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,由步骤定仪器:称量用到量筒;溶解用到烧杯和玻璃棒;移液用到容量瓶,配制100mL溶液应用100mL容量瓶,定容用到胶头滴管;在配制过程中不需用的是50mL容量瓶和分液漏斗,选BC;还需用到的玻璃仪器是玻璃棒;③A.使用容量瓶前,检查它是否漏水,正确;B、定容时液面超过刻度线,应重新配制,错误;C、配制溶液时,用量筒量取浓硝酸先在烧杯中溶解,冷却至室温后再倒入容量瓶中,然后加蒸馏水定容,错误;D、定容后盖好瓶塞,把容量瓶反复上下颠倒,摇匀,正确,选BC;④用量筒量取浓硝酸,读数时,俯视量筒,所量取的浓硝酸体积偏小,所配制溶液的浓度偏低;(2)①铜与浓硫酸在加热条件下反应的化学方程式为2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O,浓硫酸表现出来的性质是强氧化性和酸性;②MnO2与浓盐酸在加热条件下反应,生成二氯化锰、氯气和水,离子方程式为2Cl- + 4H+ + MnO2
CuSO4+SO2↑+2H2O,浓硫酸表现出来的性质是强氧化性和酸性;②MnO2与浓盐酸在加热条件下反应,生成二氯化锰、氯气和水,离子方程式为2Cl- + 4H+ + MnO2 Mn2+ + Cl2↑+ 2H2O;③根据铜与浓、稀硝酸反应的化学方程式判断,分别用浓硝酸和稀硝酸制取相同质量Cu(NO3)2晶体,消耗浓硝酸和稀硝酸的物质的量之比是3:2。
Mn2+ + Cl2↑+ 2H2O;③根据铜与浓、稀硝酸反应的化学方程式判断,分别用浓硝酸和稀硝酸制取相同质量Cu(NO3)2晶体,消耗浓硝酸和稀硝酸的物质的量之比是3:2。
