为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
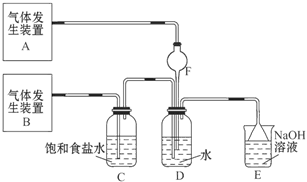
(1)气体发生装置A产生的气体是_____________。
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:①氯化铁溶液;②氯化亚铁溶液;③硫氰化钾溶液;④苯酚溶液;⑤品红溶液; ⑥酸性高锰酸钾溶液
Ⅰ.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入____________(选填一个序号)试剂,实验现象是: 。
Ⅱ.若SO2过量:取适量D中溶液滴加至盛有____________(选填一个序号)的试管内,实验现象是:__________________________________。
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
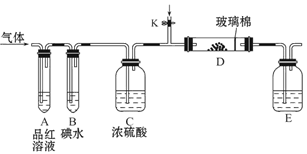
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?____________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为 。
(1)SO2
(2)Ⅰ.② ③(或④) 溶液呈红色(或紫色) Ⅱ.⑥ 溶液变成无色
(3)①相同 ② 5Cl2+I2+6H2O=2HIO3+10HCl
题目分析:(1)SO2易溶于水且与水能反应,所以通入水中溶液发生倒吸,F装置可以防倒吸,所以装置B为制取SO2的装置。
(2)Ⅰ.若Cl2过量,取适量D中溶液滴加至盛有氯化亚铁溶液试剂的试管内,Cl2可把Fe2+氧化为Fe3+,再加入硫氰化钾溶液会变血红色,或再加入苯酚溶液会变为紫色,根据溶液颜色的变化可证明氯气氧氧化亚铁离子过量。
Ⅱ.若SO2过量,取适量D中溶液滴加至盛有品红溶液的试管中,红色褪去,加热又恢复红色,证明含有二氧化硫。
(3)①二氧化硫能和有色物质反应生成无色物质,具有漂白性,氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色。
②装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,I2的物质的量为5.0×10-3 mol,说明I元素的化合价从o升高至+5价,被Cl2转化为HIO3,所以反应的化学方程式为:5Cl2+I2+6H2O=2HIO3+10HCl。
