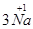问题
问答题
现有镁和氯化镁的混合物4.9g,向其中加入70.3g过量的稀盐酸充分反应后,
称得溶液质量为75g.
(1)写出上述反应的化学方程式: .
(2)该反应中产生H2的质量为: g.
(3)原混合物中氯化镁的质量为 g,反应后的溶液中氯化镁的质量分数为 .
答案
(1)镁与盐酸反应的反应物是镁和盐酸,生成物是氯化镁和氢气,用观察法配平,氢气后面标上上升符号;
(2)根据质量守恒定律可知质量的减少量就是生成氢气的质量,所以产生氢气的质量为:4.9g+70.3g-75g═0.2g;
(3)设要生成0.2g氢气需要参加反应的镁的质量为X,同时生成氯化镁的质量为Y则:
Mg+2HCl═MgCl2+H2↑
24 95 2
X Y 0.2g
根据:
=24 2
解得X=2.4所以原混合物中氯化镁的质量为:4.9g-2.4g═2.5g,根据:X 0.2g
= 95 2
解得Y=9.5g,所以反应后溶质氯化镁的质量为:9.5g+2.5g=12g,反应后溶液的质量分数为:Y 0.2g
× 100%=16%12g 75g
故答案为:
(1)Mg+2HCl═MgCl2+H2↑;
(2)0.2;
(3)2.5,16%.