问题
填空题
请仔细观察下面溶液的变化并回答问题。
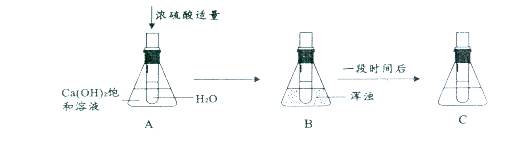
(1)A中的试管 (填“能”或“不能”)把水加人浓硫酸中。
(2)B中溶液变浑浊的原因是
(3)若把浓硫酸改为硝酸铵固体, (填“会”或“不会”)出现与上图相同的现象。
(4)在A、B、C中Ca(OH)2溶液溶质的质量分数的大小关系是 (用A、B、C和 “>”、“<”、“=”表示)
答案
(1)不能
(2 )浓硫酸溶于水放热,溶液温度升高使Ca(OH)2析出(合理给分)
(3)不会
(4)A=C>B
题目分析:(1)根据浓硫酸的稀释过程分析,稀释浓硫酸的操作应该是将浓硫酸沿容器壁慢慢注入水中,并用玻璃棒不断搅拌使热量散失,切不能把水注入浓硫酸中,否则会引起酸液飞溅而发生危险。
(2)浓硫酸稀释的过程中会放出大量的热,使溶液温度升高,而氢氧化钙的溶解度会随温度的升高而变小,故饱和的氢氧化钙溶液中会有溶质析出,而使溶液变浑浊。
(3)由于硝酸铵固体溶于水时会吸热,使溶液温度降低,故不会出现与上图相同的现象。
(4)根据图示可知,A、C是常温下的氢氧化钙的饱和溶液,B是温度升高后的氢氧化钙的饱和溶液,由于氢氧化钙的溶解度随温度升高而降低,再结合饱和溶液的溶质质量分数=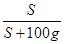 ×100%,可知溶质质量分数的关系是A=C>B。
×100%,可知溶质质量分数的关系是A=C>B。
点评:本题难度不大,但涉及的知识点较多,属于对基础知识的考查,要求学生在平时的学习中要加强相关知识的储备,其中解题的关键是要会利用浓硫酸的稀释放热,对氢氧化钙的溶解度及溶液组成的变化进行分析比较。
