下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
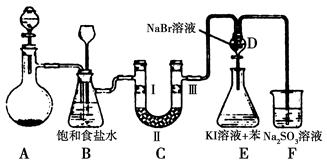
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为________。
(2)装置B中饱和食盐水的作用是________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:__________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________该现象________(填“能”或“不能”)说明溴的非金属性强于碘,原因是__________________________。
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:__________________。请判断改用NaHSO3溶液是否可行?________(填“是”或“否”)。
(1)Ca(ClO2)+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱
(3)d
(4)E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2
(5)HSO3—+Cl2+H2O=SO42—+2Cl-+3H+(或4HSO3—+Cl2=SO42—+2Cl-+3SO2+2H2O) 否
(1)漂粉精中的次氯酸钙与浓盐酸反应生成氯气。(2)由于浓盐酸具有挥发性,从A装置出来的氯气中含有氯化氢气体,故用B中的饱和食盐水除去其中的氯化氢。(3)若验证氯气是否有漂白性,则应该先验证氯气是否能够使湿润的有色布条褪色。(4)读图可知,D中通入氯气后生成单质溴,加入E中后又生成了单质碘,故E中现象是溶液分层,且上层即苯层显紫红色,但是由于D中可能有过量的氯气,故E中生成的单质碘不一定是溴与KI反应置换出来的,故不能说明溴的非金属性一定比碘强。(5)由于氯气具有氧化性,与NaHSO3发生氧化还原反应HSO3—+Cl2+H2O=SO42—+2Cl-+3H+,由于NaHSO3溶液显酸性,会抑制氯气的吸收,故不能选用NaHSO3溶液吸收氯气。
点拨:本题考查氯气的制备及相关性质,考查考生综合分析问题和解决问题的能力。难度较大。
