浓硫酸在高中化学实验中有着很重要的作用
(1)①铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色固体。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。则黑色固体中含有________元素。
②实验室利用浓硫酸分别与氯化钠固体和碘化钾固体加热反应制取所需物质,分析这两个反应中浓硫酸作用的异同点:_________________________________ 。
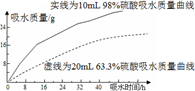
(2)探究浓硫酸的吸水性。某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图。由右图曲线你能得到的实验结论有哪些?(写两点)______、_______________。
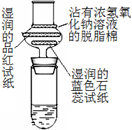
(3)苯与浓硝酸、浓硫酸制硝基苯的实验中,三种原料混合的顺序是_____________;要得到纯净的硝基苯,需经过:水洗 → 5%NaOH溶液洗涤 → 水洗 → 无水CaCl2干燥→________(填写操作),得到纯硝基苯。
(4)探究浓硫酸在生成乙酸乙酯反应中的作用。
问题提出:浓硫酸存在条件下酯化反应是否进行得更快。
设计实验:____________________。实验现象:___________________ 。
(5)浓硫酸与蔗糖反应的演示实验装置修改如下:实验时在大试管中先放入2g细小颗粒的蔗糖,滴加2—3滴碳酸钠浓溶液,再加入1.5mL 98%的浓硫酸,迅速塞紧带干燥管的单孔橡皮塞。可以看到,蔗糖迅速变黑,体积急剧膨胀,形成多孔海绵状固体物质——“黑面包”。分析实验效果更加明显的原因:____________________________________________________ 。
(6)苯分子等芳香烃化合物里的氢原子被硫酸分子里的磺酸基(—SO3H)所取代的反应,称为磺化反应。浓硫酸有时也用SO3代替浓硫酸,其优点是____________________、__________________。(至少写出两点)
用浓硫酸吸收SO3可得发烟硫酸(H2SO4·SO3)。某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)________m3(保留2位小数)。
(1)Cu、S;相同点均为难挥发性的酸,不同点后者还有强氧化性。
(2)98%硫酸和63.3%硫酸都具有吸水性; 98%硫酸吸水能力比63.3%硫酸强(吸水速度快、吸水量大)
(3)在浓硝酸中慢慢注入浓硫酸,摇匀冷却,在混合酸中慢慢滴入苯,使其混合均匀;蒸馏
(4)比较有、无浓硫酸存在条件下酯化反应进行的快慢;相同时间内有浓硫酸的反应收集到的油状物较多,无浓硫酸存在的反应几乎收集不到油状物。
(5)碳酸钠与浓硫酸反应及浓硫酸遇水均是放热过程,使体系温度升高,同时浓硫酸与碳酸钠反应产生二氧化碳使脱水后生成的炭更加疏松多孔。
(6)磺化时不生成水,废液少、反应快,三氧化硫用量可接近理论量。3.49 。
题目分析:
(1)①向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,证明溶液中含有Cu元素;向所得溶液加BaCl2溶液后有白色沉淀生成。证明溶液中含有SO42-,则又黑色固体中含有S元素。因此该固体中含有Cu、S量元素。
②浓硫酸与两种物质发生的反应为2NaCl+H2SO4(浓)  Na2SO4+2HCl↑;2NaI+2H2SO4(浓)
Na2SO4+2HCl↑;2NaI+2H2SO4(浓)  Na2SO4+2H2O+SO2↑+I2。在这两个反应中都利用了浓硫酸的难挥发性,不同的是后者还同时利用了它的强氧化性。
Na2SO4+2H2O+SO2↑+I2。在这两个反应中都利用了浓硫酸的难挥发性,不同的是后者还同时利用了它的强氧化性。
(2)由图中曲线能得到的实验结论有98%的硫酸和63.3%的硫酸都有吸水性;98%硫酸吸水能力比63.3%硫酸强;相同的时间98%的硫酸吸水量大;吸水相同量时98%的硫酸消耗时间短。
(3)在苯与浓硝酸、浓硫酸制硝基苯的实验中,酸的混合时与浓硫酸的稀释相似,即先加入密度小的物质,再加入密度大的物质。由于两种酸混合时放出大量的热,而苯的沸点较低,因此要等酸混合液冷却后再加入苯。故三种原料混合的顺序是在浓硝酸中慢慢注入浓硫酸,摇匀冷却,在混合酸中慢慢滴入苯,使其混合均匀;制得的硝基苯中含有硫酸、硝酸、水。要得到纯净的硝基苯,需经过水洗(除去大量的酸) → 5%NaOH溶液洗涤(中和剩余残留的少量的酸) → 水洗(除去表面的盐离子) → 无水CaCl2干燥(吸水)→最后蒸馏即可。
(4)设计实验:在两只相同的试管中分别加入等体积的无水乙酸、乙醇,然后向其中的一个试管中加入5ml的浓硫酸,把导气管通到盛有饱和Na2CO3溶液的试管中,要始终保持导气管管口在液面以上,给试管加热。观察在盛有饱和Na2CO3溶液的试管液面上油状物的多少及气味,比较有、无浓硫酸存在条件下酯化反应进行的快慢;结果发现:相同时间内有浓硫酸的反应收集到的油状物较多,无浓硫酸存在的反应几乎收集不到油状物。结论:浓硫酸存在条件下酯化反应进行得更快。浓硫酸在该反应中起催化剂、吸水剂的作用。
(5)碳酸钠与浓硫酸反应是放热反应;浓硫酸遇水也是个放热过程,这会使体系温度升高,温度升高,浓硫酸的氧化性增强,温度升高,化学反应速率加快;同时浓硫酸与碳酸钠反应产生二氧化碳可以使脱水后生成的炭更加疏松多孔。因此实验效果更明显。
(6)用SO3代替浓硫酸,可以减少水的产生,反应速率快,废物少.由发烟硫酸的化学式及元素在稀释过程在守恒可得:2×{(1.84×1.5×106×98.3%)÷98}=(1.79V×106×95%)÷98.整理可得V=3.49。
