某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
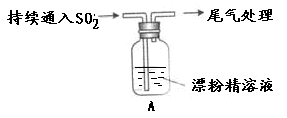 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。
(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(2)①验证Cl2存在②与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3
(3)①CaSO4 ②SO2+Cl2+2H2O=4H++SO42-+2Cl- (4)42.90%(4分,数据对且符合有效数字要求)
题目分析:(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水;(2)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;(3)①A瓶中混合物过滤、洗涤得沉淀X,向X中加入稀HC1,无明显变化,不含CaSO3。取上层清液,加入BaC12溶液,产生白色沉淀,说明有SO42-。故X中含有的物质是CaSO4;②iii中黄绿色褪去的原因是SO2还原了Cl2的原因:SO2+Cl2+2H2O=4H++SO42-+2Cl-;(4)根据反应原理可知3~2KI,平均消耗KI为20.00mL,为20.00×10-3×0.2000mol=4.000mol,即漂白粉含6.000×10-3mol Ca(C1O)2,即0.8580g,故该漂白粉中有效成分的质量分数为42.90%。
