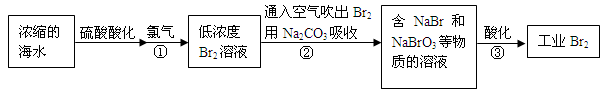
(12分)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBrb.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
(12分,每空2分)
(1) 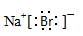
(2)Cl2+2Br— Br2+2Cl—(物质1分,配平1分)
Br2+2Cl—(物质1分,配平1分)
(3)富集溴
(4)3Br2+3Na2CO3 5NaBr+3CO2+NaBrO3 (物质1分,配平1分)
5NaBr+3CO2+NaBrO3 (物质1分,配平1分)
(5)5
(6)b
题目分析:(1)NaBr是离子化合物,其电子式为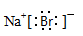
(2)反应①是氯气与溴离子反应生成溴单质和氯离子,离子方程式为Cl2+2Br— Br2+2Cl—
Br2+2Cl—
(3)溴易挥发,碳酸钠溶液显碱性,与吹出的溴反应,减少损失,达到富集溴的目的;
(4)反应②的反应物是溴与碳酸钠,根据题目所给信息,生成物是NaBr和NaBrO3及二氧化碳,化学方程式为3Br2+3Na2CO3 5NaBr+3CO2+NaBrO3
5NaBr+3CO2+NaBrO3
(5)反应③是5Br-+H++BrO3-= 3Br2+H2O,则每生成3 mol Br2,转移电子的物质的量是5mol;
(6)a、氯气不与溴化氢反应,不能除去,错误;b、氯气与溴化钠反应生成溴和氯化钠,正确;c、氯气与溴单质都能与碳酸钠溶液反应,错误;d、氯气与溴都能氧化亚硫酸钠,错误,答案选b。
