问题
选择题
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
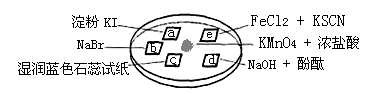
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 氧化性:Cl2 > Fe3+ |
答案
答案:D
题目分析:KMnO4与浓盐酸发生反应产生氯气,A.在a处发生反应:Cl2+2KI=2KCl+I2. I2遇淀粉会变为蓝色。在b处发生反应:Cl2+2NaBr=2NaCl+Br2。这只能证明氧化性Cl2>Br2;Cl2> I2。但是不能证明Br2>I2。错误。B. 在c处发生反应Cl2+H2O HCl+HClO,HCl是酸,电离产生H+使溶液显酸性,能使湿润的蓝色石蕊试纸变红,由于还产生了有强氧化性的HClO,它能把有色物质氧化为无色物质,所以后来又褪色。错误。C.在d处发生反应:Cl2+2NaOH=NaCl+NaClO+H2O。由于碱被消耗,溶液的碱性减弱,所以酚酞的红色逐渐变浅。错误。D.在e处发生反应:2Fe2++Cl2= 2Cl-+2Fe3+;Fe3++ 3SCN-=Fe(SCN)3.溶液变为血红色。证明了氧化性Cl2 > Fe3+。正确。
HCl+HClO,HCl是酸,电离产生H+使溶液显酸性,能使湿润的蓝色石蕊试纸变红,由于还产生了有强氧化性的HClO,它能把有色物质氧化为无色物质,所以后来又褪色。错误。C.在d处发生反应:Cl2+2NaOH=NaCl+NaClO+H2O。由于碱被消耗,溶液的碱性减弱,所以酚酞的红色逐渐变浅。错误。D.在e处发生反应:2Fe2++Cl2= 2Cl-+2Fe3+;Fe3++ 3SCN-=Fe(SCN)3.溶液变为血红色。证明了氧化性Cl2 > Fe3+。正确。
