问题
问答题
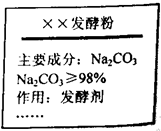
市售某发酵粉的包装袋上有如图所示说明:
称取该发酵粉5.4g放入烧杯中,再滴加稀盐酸至溶液显酸性,共用去稀盐酸25.4g,得到的液态混合物质量为28.6g(忽略C02在水中的溶解,杂质溶于水但不与稀盐酸反应放出气体).
(1)生成的C02的质量为______g.
(2)通过计算,判断该发酵粉中Na2C03的质量分数是否与包装说明相符(计算结果精确0.1%)?
可能需要的相对原子质量:Na(23)、C(12)、O(16)、H(I)、Cl(35.5).
答案
(1)由质量守恒定律可知生成的二氧化碳质量是5.4g+25.4g-28.6g=2.2g
(2)设发酵粉中纯Na2C03的质量为x,则
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10644
x2.2g
=106 x 44 2.2g
x=5.3g
样品中Na2C03的质量分数
×100%=98.1%>98%5.3g 5.4g
故答案为:(1)2.2;(2)答:该发酵粉中Na2C03的质量分数与包装说明相符.
