问题
实验题
酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
| (2)右图是某试剂瓶标签上的内容。 | |
| 要把10 g这种浓硫酸稀释为20%的硫酸, | |
| 需要水的质量为 g。稀释浓硫酸时, | |
| 不可将水倒进浓硫酸里,请解释其原因。 |  |
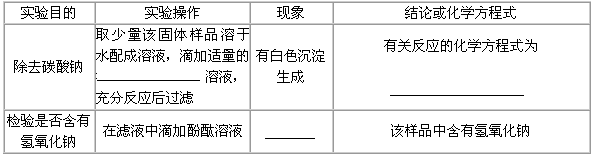
| ②为探究该固体中是否还有未变质的氢氧化钠, | |
| 同学们又进行了如下表所示的实验。已知碳酸钠 | |
| 的水溶液呈碱性,它的存在会对氢氧化钠的 | |
| 检验造成干扰。请根据右图部分物质的溶解性表 | |
| (20℃)所提供的信息,将下表填写完整。 | 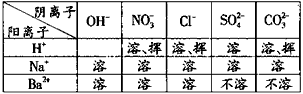 |
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。
答案
(1)瓶口出现白雾的是浓盐酸,因为浓盐酸有挥发性。
(2)39;水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水沸腾,造成酸液飞溅。
(3) ① 盐酸(或硫酸等)
② 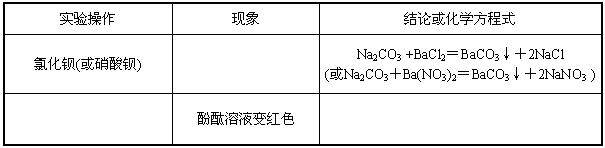
(4)解:设反应后,生成氯化钠的质量为x
HCl+NaOH===NaCl+H2O
36.5 58.5
73g×20% x
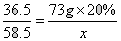 x=23.4g
x=23.4g
反应后所得溶液中溶质的质量分数为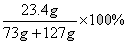 =11.7%
=11.7%
