某兴趣小组的同学在实验室用含有少量氯化钙的氯化钠固体配制一定质量分数的氯化钠溶液,实验步骤如下图所示:
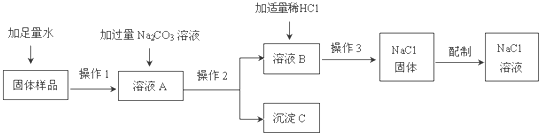
请回答:
(1)在“操作2”中,要用到的玻璃仪器除玻璃棒、烧杯外,还有 。
(2)加入“适量稀HCl”的目的是 。
(3)生成沉淀C的化学方程式 。
(4)“操作3”的名称是 。
(5)用提纯的NaCl配制50g质量分数为 6%的氯化钠溶液,需要NaCl的质量为 g。
(6)如配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液(密度为1.04g/cm3)和水的质量分别为:6%的氯化钠溶液体积 mL;水 g。
(7)在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会 (填“偏高”、“偏低”、或“无影响”)。
(1)漏斗; (2)除去溶液中的碳酸钠、氢氧化钠; (3)CaCl2+Na2CO3=2NaCl+CaCO3↓;
(4)蒸发;(5)3; (6)24.04; 25; (7)偏高
题目分析:(1)要将不溶性的固体分离,需要进行过滤操作,过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒;
(2)加入碳酸钠后,和氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,所以溶液B中存在反应剩余的碳酸钠和生成的氢氧化钠,但是两者对于氯化钠都是杂质,所以加入稀盐酸是为了除去溶液中的氢氧化钠和碳酸钠;
(3)根据稀盐酸和碳酸钙的反应原理书写方程式。碳酸钠和氯化钙反应生成氯化钠和碳酸钙沉淀,方程式是:CaCl2+Na2CO3=2NaCl+CaCO3↓;
(4)氯化钠的溶解度受温度影响变化较小,要得到氯化钠晶体需要蒸发溶剂;
(5)溶质质量=溶液质量×溶质质量分数,是50g×6%=3g;
(6)配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液(密度为1.04g/cm3)的质量是: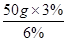 =25g,体积是:
=25g,体积是: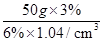 ≈24.04mL,则需要水的质量为50g﹣25g=25g;
≈24.04mL,则需要水的质量为50g﹣25g=25g;
(7)根据正确使用量筒读数的方法进行分析,并进而分析溶质的质量分数变化。在使用量筒读数时,视线要与凹液面的最低处保持水平,俯视导致读数偏大,实际量取液体就偏少,所以导致溶液浓度偏高。
