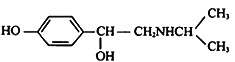
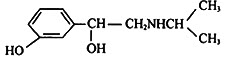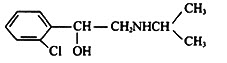金属用途广泛,其结构和性质等是化学的重要研究内容.
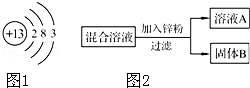
(1)如图1是铝的原子结构示意图.下列说法不正确的是 .
A.铝原子在反应中易得电子
B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的金属元素
D.铝可作导线是由于它具有良好的导电性(2)某化学小组用一定量NaNO3和Cu(NO3)2混合溶液进行了图2实验,并对溶液A和固体B的成分进行了分析和实验探究.
[提出问题]溶液A中的溶质可能有哪些?
[作出猜想]①只有Zn(NO3)2②Zn (NO3)2、Cu(NO3)2 ③Zn (NO3)2、NaNO3
[交流讨论]合理的猜想是 (填标号),其理由是 .
[实验探究]通过以下实验可确定固体B的成分,请将表填写完整.
| 实验步骤 | 现 象 | 有关反应的化学方程式 |
| 取固体B少量,滴加 | 有气泡产生 | (或 ) |
(4)黄铜(Cu﹣Zn合金)20g与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为119.6g.计算稀硫酸中溶质的质量分数(计算结果精确到0.1%)
(1)A;(2)③,Zn不能NaNO3与反应,故溶质中一定含有NaNO3
实验步骤现象有关反应的化学方程式
稀盐酸(或稀硫酸等)Zn+2HCl=ZnCl2+H2↑
(或Zn+H2SO4=ZnSO4+H2↑)
(3)CO,Fe2O3+3CO 2Fe+3CO2;(4)稀硫酸中溶质的质量分数为19.6%.
2Fe+3CO2;(4)稀硫酸中溶质的质量分数为19.6%.
题目分析:(1)A,铝原子的最外层电子数是3,少于4个,在化学反应中已失去电子.说法错误;B、在化合物中铝通常显+3价,说法正确;C.铝是地壳中含量最多的金属元素,说法正确;D.铝可作导线是由于它具有良好的导电性,说法正确;(2)[交流讨论]由金属活动性顺序表的应用可知,Zn不能 NaNO3与反应,故溶质中一定含有NaNO3,所以,合理的猜想是③;[实验探究]由金属活动性顺序表的应用可知,B中一定有铜,根据锌与酸的反应可确定是否含有锌,设计实验如下:
实验步骤现象有关反应的化学方程式
稀盐酸(或稀硫酸等)Zn+2HCl=ZnCl2+H2↑
(或Zn+H2SO4=ZnSO4+H2↑)
(3)在炼铁炉中焦炭的作用是通过燃烧提供能量和CO,有铁生成的化学方程式为:Fe2O3+3CO 2Fe+3CO2;
2Fe+3CO2;
(4)氢气的质量为:20g+100g﹣119.6g=0.4g
设稀硫酸中溶质的质量分数为x%.
Zn+H2SO4=ZnSO4+H2↑
98 2
100g×x% 0.4g
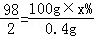 解得:x%=19.6%
解得:x%=19.6%
答:稀硫酸中溶质的质量分数为19.6%.