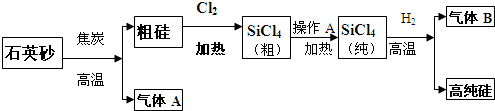
晶体硅是一种重要的非金属材料,在现代电子工业中具有非常重要的应用.工业上制备高纯硅的主要步骤如下:
(1)下列有关硅及化合物的说法,正确的是______.
A.石英的主要成分是SiO2
B.太阳能电池使用单质硅做材料,其应用有利于环保、节能
C.粗硅制备高纯硅的过程不涉及氧化还原反应
D.玻璃、水泥、陶瓷都属于硅酸盐产品
(2)SiCl4在室温下为无色液体,易挥发,粗硅与氯气反应得到的粗SiCl4中含有大量固体杂质,通过“操作A”提纯得到纯SiCl4,操作A的名称是______.
(3)整个制备过程必须严格控制无水无氧.H2还原SiCl4过程中发生的反应是:______在该过程中若有O2混入,可能引起的后果是______.
(1)A、因石英的主要成分为SiO2,故A正确;
B、因硅可用来制电池的材料,这一应用有利于环保、节能,故B正确;
C.因粗硅制备高纯硅的过程中有两个反应为氧化还原反应:Si+2Cl2
SiCl4、SiCl4+2H2 高温 .
Si+4HCl;故C错误; 高温 .
D.因常见的硅酸盐材料有:玻璃、水泥、陶瓷,故D正确;
故答案为:ABD
(2)因SiCl4在室温下为无色液体,易挥发,粗SiCl4中含有大量固体杂质,可先对SiCl4进行汽化,然后进行液化达到分离的目的,故答案为:蒸馏(分馏、精馏均可)
(3)因SiCl4与H2反应可得高纯硅和气体,可知气体为HCl,故答案为:2H2+SiCl4
Si+4HCl, 高温 .
因H2和O2混合容易发生爆炸,故答案为:引起爆炸.
