问题
问答题
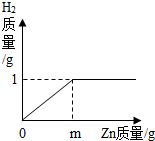
已知烧杯中装有200g硫酸和硫酸锌混合溶液,其中含硫酸锌12.1g.向烧杯中逐渐加入锌粒,放出气体质量与加入锌粒质量的关系如图所示.当恰好完全反应时,所得的溶液为不饱和溶液.
请计算:
(1)m的值.
(2)原混合溶液中H2SO4的质量分数.
(3)恰好完全反应时,所得溶液中溶质的质量分数.
答案
设恰好完全反应时参加反应的Zn、H2SO4的质量分别为m、x,生成ZnSO4的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65981612
mxy1g
(1)根据:
=65 2
解得m=32.5gm 1g
(2)根据:
=98 2
解得x=49g所以H2SO4的质量分数=x 1g
×100%=24.5%49 200
(3)根据:
=161 2
解得y=80.5g,恰好完全反应时,所得溶液中ZnSO4的质量为:80.5g+12.1g=92.6g,反应后溶液质量为:200g+32.5g-1g=231.5g,所以恰好完全反应时,所得溶液中溶质的质量分数:y 1g
×100%=40%.92.6g 231.5
故答案为:(1)32.5g;(2)24.5%;(3)40%.
