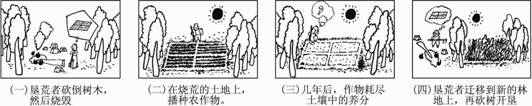
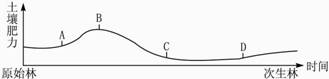
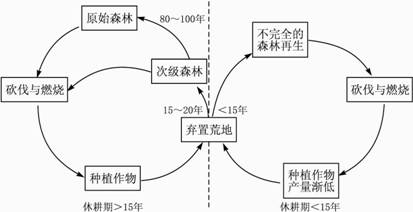
问题
问答题
为测定某MgSO4溶液的溶质质量分数,化学小组同学取MgSO4溶液100g,向其中加入一定溶质质量分数的NaOH溶液80g,二者恰好完全反应,生成沉淀5.8g.
请计算:
(1)该MgSO4溶液的溶质质量分数是多少?
(2)反应后所得溶液的质量是多少克?
答案
(1)设参加反应的硫酸镁的质量是x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
120 58
x5.8g
=120 x 58 5.8g
x=12g
故硫酸镁溶液的溶质质量分数为
×100%=12%12g 100g
(2)反应后溶液的质量为100g+80g-5.8g=174.2g
答:(1)该MgSO4溶液的溶质质量分数是12%;(2)反应后所得溶液的质量是174.2g;