取50.00g某质量分数浓度的NaOH溶液,向其中通入二氧化碳气体后,再向溶液中逐滴滴入18.25%的盐酸,产生CO2气体的质量(假设反应后CO2完全逸出)与所加的盐酸体积之间的关系如右图所示.(保留两位小数)
(相对原子质量:H:1C:12O:16Na:23Cl:35.5)
(1)计算原NaOH溶液的质量分数浓度.
(2)求NaOH溶液中通入CO2后,所得溶液中的溶质及其质量.(保留两位小数)
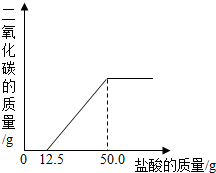
(1)由图象可知,反应结束时消耗的盐酸为50.0g,此时溶液中的溶质为氯化钠,
设原NaOH溶液的溶质的质量为x,
则由原子守恒可得 NaCl~HCl~NaOH,
36.540
50.0g×18.25% x
=36.5 40
,解得x=10g,50.0g×18.25% x
则原NaOH溶液的质量分数为
×100%=20.00%,10g 50.00g
答:原NaOH溶液的质量分数为20.00%;
(2)①由图象可知,NaOH溶液中通入CO2后,溶质为NaOH和Na2CO3,
设质量分别为m、n,则
NaOH+HCl═NaCl+H2O
40 36.5
m 12.5g×18.25%
=40 36.5
,m 12.5g×18.25%
解得m=2.50g,
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 73
n (50-12.5)g×18.25%
=106 73
,n (50-12.5)g×18.25%
解得n=9.94g,
②溶质为碳酸钠和碳酸氢钠.设它们的质量分别为x、y,生成的碳酸氢钠为z,则
Na2CO3+HCl═NaCl+NaHCO3,
106 36.5 84
x 12.5g×18.25% z
=106 36.5
,x 12.5g×18.25%
=36.5 84
,解得x=6.63g,z=5.25g12.5g×18.25% z
NaHCO3+HCl═NaCl+CO2↑+H2O
84 36.5
(y+5.25g)(50-12.5)g×18.25%
=84 36.5
,解得y=10.50g,(y+5.25g) (50-12.5)g×18.25%
答:NaOH溶液中通入CO2后,所得溶液中的溶质若为NaOH和Na2CO3,质量分别为2.50g、9.94g;若为碳酸钠和碳酸氢钠,质量分别为6.63g、10.50g.
