问题
实验题
Ⅰ(5分)⑴用14.2g无水硫酸钠配制成500 ml溶液,其物质的量浓度为 ▲ mol/L。
⑵若从上述溶液中取出10 ml,则这10 ml 溶液的物质的量浓度为 ▲ mol/L,含溶质的质量为 ▲ g。
⑶若将上述10 ml 溶液用水稀释到100 ml,所得溶液中Na+的物质的量浓度为 ▲ mol/L;若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCL2溶液
▲ ml 。
Ⅱ(6分)现有36%的醋酸(CH3COOH),密度为1.04g/ml.,
欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸 ▲ ml。
需要使用的实验仪器有烧杯、 ▲ 、 ▲ 、 ▲ 、 ▲ ,
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 ▲ (填“正确”、“偏大”或“偏小”)。
▲ (填“正确”、“偏大”或“偏小”)。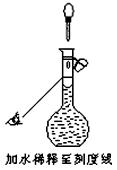
答案
(11分)Ⅰ⑴ 0.2 ⑵ 0.2;0.284 ⑶ 0.04;20(每空1分)
Ⅱ 4; 10ml量筒;玻璃棒; 250ml容量瓶;胶头滴管;偏小(每空1分)
