问题
问答题
在研究某铜锌合金样品的活动中,兴趣小组同学进行了如下实验,过程如图所示: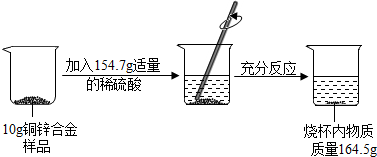
试计算:
(1)产生氢气的质量;
(2)样品中铜的质量分数;
(3)将反应后烧杯内剩余的物质过滤,求所得滤液中溶质的质量分数.
答案
(1)根据质量守恒定律可以知道生成氢气的质量为:10g+154.7g-164.7g=0.2g
(2)设锌的质量为x,生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
651612
x y0.2g
=65 x
=136 y 2 0.2g
解得:x=6.5g,y=16.1g
样品中铜的质量分数为:
×100%=35%10g-6.5g 10g
(3)所得滤液中溶质的质量分数为:
×100%=10%.16.1g 164.7g-3.5g-0.2g
答:(1)产生氢气的质量为0.2g;
(2)样品中铜的质量分数为35%;
(3)所得滤液中溶质的质量分数为10%.