某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表。
| 甲 | 乙 | 丙 | 丁 | |
| 所取固体样品的质量/g | 25 | 25 | 20 | 20 |
| 加入硫酸溶液的质量/g | 50 | 100 | 100 | 120 |
| 反应剩余固体质量/g | 21 | 17 | 12 | 12 |
| 反应掉固体的质量/g | 4 | 8 | 8 |
(1)丙同学实验所用20g样品中有 g的 参加了反应;
(2)四位同学中, 两位同学所取的硫酸溶液质量不足(填写“甲”、“乙”、“丙”或“丁”);
(3)计算混合物氧化铜的质量分数;
(4)计算硫酸溶液中的溶质质量分数。
(1)8 CuO(或氧化铜) (2)甲、乙 (3)m(CuO)=" 20g-12g" =" 8g" ω(CuO) = 40% (4) ω(H2SO4) = 9.8%
析:根据金属活动性铜活动性处于H之后,不能与稀硫酸反应,因此铜和氧化铜的混合物加入稀硫酸,只有氧化铜与硫酸发生反应;分析表中数据找出恰好完全反应的实验数据进行计算.
解答:解:由表中数据对比分析:丙中反应前固体是20g,反应后固体是12g,故反应的氧化铜质量为8g,由丁和丙对比,固体混合物相同,酸由100g增加到120g,反应掉的氧化铜仍为8g,说明20g混合物中只含8g氧化铜.由乙丙对比固体混合物质量不同,酸相同,而反应掉的氧化铜相同都是8g,说明25g混合物中的氧化铜没有全部反应,即100g稀硫酸能与20g混合物中的8g氧化铜恰好完全反应.所以甲乙两同学硫酸量不足,丙同学恰好完全反应,丁同学酸剩余.
(1)丙同学的实验中,混合物为20g,剩余固体为12g,所以样品中有8g的氧化铜 参加了反应;
(2)四位同学中,甲乙 两位同学所取的硫酸溶液质量不足;
(3)混合物中氧化铜的质量分数=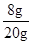 ×100%=40%
×100%=40%
(4)根据化学方程式中氧化铜的质量可求出硫酸的质量,从而求出硫酸的质量分数.
故答案为:
(1)8; CuO
(2)甲、乙
(3)氧化铜的质量:20g-12g=8g
氧化铜的质量分数: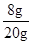 ×100%=40%
×100%=40%
(4)设参加反应的硫酸质量为X
CuO+H2SO4═CuSO4+H2O
80 98
8g X
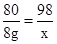
X=9.8g
硫酸的质量分数:
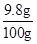 ×100%=9.8%
×100%=9.8%
答:硫酸溶液中溶质的质量分数9.8%.
