某化学实验小组为测定生石膏的组成(CaSO4•xH2O),即测x的值,做了如下实验,将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量,随着实验次数的增加,加热的时间不断延长.它们的实验数据理如下:
| 实验顺序 (按序延长加热时间) | 固体质量/g | |
| 加热前 | 加热后 | |
| 1 | 3.44 | 3.26 |
| 2 | 3.44 | 3.12 |
| 3 | 3.44 | 2.90 |
| 4 | 3.44 | 2.90 |
| 5 | 3.44 | 2.80 |
| 6 | 3.44 | 2.78 |
| 7 | 3.44 | 2.72 |
| 8 | 3.44 | 2.72 |
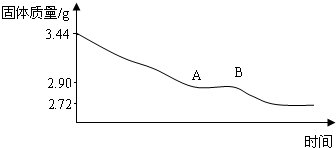
(1)利用实验数据,通过计算推断生石膏的化学式.
(2)通过计算解释图象中产生AB段的原因.
(1)石膏加热分解减少的质量就是水的质量,由实验数据知3.44gCaSO4•xH2O完全分解得到无水CaSO42.72g,则:
CaSO4•xH2O═CaSO4+xH2O
13618x
2.720.72
即136:2.72=18x:0.72 解得x=2 所以石膏的化学式为CaSO4•2H2O.
(2)由实验数据知在A-B段时石膏的质量为2.90g,其中CaSO42.72g,H2O0.18g.此时其化学式可表示为2CaSO4•H2O.
故答案为:
(1)CaSO4•2H2O;
(2)原因是石膏的质量为2.90g,根据图中数据可知最后固体质量不变,说明已经没有了结晶水,即CaSO4质量为2.72g,所以H2O的质量为2.90g-2.72g═0.18g.则硫酸钙与水的质量比为:272:18,因为硫酸钙与水的相对分子质量比为136:18,所以硫酸钙前面应该放上2,所以此时其化学式可表示为2CaSO4•H2O.该物质化学性质稳定,受热不易分解.
