问题
问答题
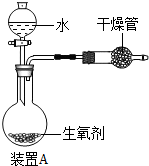
有一种自生氧防毒面具,其使用的生氧剂的主要成分是KO2.某研究小组取100g生氧剂放入装置A中,加入足量水使之充分反应(4KO2+2H2O═4KOH+3O2↑),测定反应前后装置A的总质量.他们进行了三次实验,测定结果如下:
| 测定序号 | 第1次 | 第2次 | 第3次 | 平均值 |
| 反应前装置A总质量(g) | 400.1 | 400.2 | 399.7 | 400.0 |
| 反应后装置A总质量(g) | 376.1 | 376.1 | 375.8 | 376.0 |
(1)100g生氧剂与水反应生成的氧气质量;
(2)生氧剂中含钾元素的质量分数.
答案
(1)100g生氧剂与足量水反应生成的氧气质量为400g-376g=24g;
(2)设生氧剂中KO2的质量为x
4KO2+2H2O═4KOH+3O2↑
28496
x 24g
=284 x
,x=71g96 24g
生氧剂中钾元素的质量分数:
×100%=39%71g× 39 71 100g
答:该生氧剂中钾元素的质量分数是39%.
