问题
问答题
某兴趣小组为测定一包碳酸钠样品中碳酸钠的质量分数,进行实验.测得相关数据如图所示:
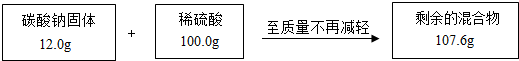
提示:①反应原理Na2CO3+H2SO4═NaSO4+H2O+CO2↑
②样品中的杂质不参加反应
③计算结果保留一位小数
(1)根据质量守恒定律,反应生成二氧化碳的质量为______g.
(2)计算该样品中碳酸钠的质量分数.(写出计算过程)
答案
(1)根据质量守恒定律可知,反应前后混合物减少的质量就是生成二氧化碳的质量,所以反应生成二氧化碳的质量=12.0g+100.0g-107.6g=4.4g;故填:4.4;
(2)设样品中碳酸钠的质量为x.
Na2CO3+H2SO4═NaSO4+H2O+CO2↑
106 44
x4.4g
=106 x 44 4.4g
x=10.6g
该样品中碳酸钠的质量分数=
×100%=88.3%10.6g 12g
答:该样品中碳酸钠的质量分数为88.3%.
