某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.
(1)写出AB段发生反应的化学方程式______.
(2)计算A点的纵坐标______.
(3)求该固体混合物中NaOH的质量.
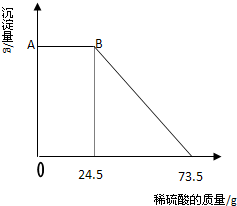
(1)物质之间的反应有MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,2NaOH+H2SO4=Na2SO4+H2O,Mg(OH)2+H2SO4═MgSO4+2H2O;由图示数据可知,开始加入硫酸至24.5g时,沉淀没有减少,是因为硫酸在与氢氧化钠反应,故反应的化学方程式为:2NaOH+H2SO4=Na2SO4+H2O;
(2)由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的质量为:73.5g-24.5g=49g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
═58 98 x 9.8g
解之得:x=5.8g;故A点的纵坐标为5.8.
(3)设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y5.8g
═120 58 y 5.8g
解之得:y=12g;
所以氢氧化钠的质量为24g-12g=12g,
答:固体混合物中NaOH的质量为12g.
