问题
问答题
某学生用含有碳酸钠杂质的烧碱样品与盐酸发生反应.取了13.3g氢氧化钠固体样品加适量的水配成溶液,向其中加入200g 7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设气体全部逸出).
求:(1)样品中碳酸钠的质量为______g.
(2)和氢氧化钠反应的稀盐酸的质量(写出计算过程)
(3)在图中画出以纵坐标表示二氧化碳质量,横坐标表示稀盐酸的质量的关系图.
答案
(1)设样品中碳酸钠的质量为x,碳酸钠消耗盐酸的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 7344
xy×7.3%2.2g
=106 x 44 2.2g
x=5.3g
=73 y×7.3% 44 2.2g
y=50g
答:样品中碳酸钠的质量为5.3g;
(2)设和氢氧化钠反应的稀盐酸的质量为z.
氢氧化钠的质量=13.3g-5.3g=8g
NaOH+HCl═NaCl+H2O
40 36.5
8gz×7.3%
=40 8g 36.5g z×7.3%
z=100g
答:和氢氧化钠反应的稀盐酸的质量为100g.
(3)开始氢氧化钠和盐酸反应不放出二氧化碳,其中氢氧化钠消耗盐酸的质量为100g,然后碳酸钠和盐酸反应放出二氧化碳,其中碳酸钠消耗盐酸的质量为50g,生成二氧化碳的质量为2.2g,所以关系图为: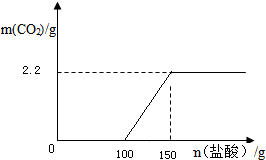 .
.
