现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案.
【实验一】取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某盐酸中,测得三组实验数据见下表(气体的溶解忽略不计):
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 盐酸的质量/g | 20 | 40 | 60 |
| 生成气体的质量/s | 2.2 | 4.4 | 5.5 |
(1)100g碱性调味液与盐酸完全反应生成气体的质量为______g.
(2)碱性调味液中碳酸钠的质量分数为多少?(写出计算过程)
(3)100g碱性调味液与该盐酸反应后溶液pH=7时,需要盐酸的质量为______g
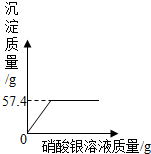
【实验二】在上述第Ⅲ组反应后的溶液中加AgNO3溶液,测得实验数据见下图:
根据实验及有关数据进行分析:
(4)某同学计算出碱性调味液中氯化钠的质量分数为20.5%(保留到小数点后一位)后经检查无数字运算错误.请判断该计算结果是否正确,如不正确要指出错误原因.______.
(1)根据前两组实验数据分析可知每20克盐酸完全反应生成2.2克二氧化碳,则60克盐酸完全反应应生成6.6克二氧化碳,在第三组实验中加入60克盐酸只生成5.5克二氧化碳,说明第三组实验中盐酸有剩余,碳酸钠反应完,所以100g碱性调味液与盐酸完全反应生成气体的质量为5.5克.故答案为:5.5
(2)设与盐酸反应的碳酸钠的质量为x.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
10644
x5.5g
=106 x 44 5.5g
x=13.25g
碱性调味液中碳酸钠的质量分数=
×100%=13.25%13.25g 100g
答:碱性溶液中碳酸钠的质量分数为13.25%.
(3)根据实验数据分析可知每生成1.1克二氧化碳参加反应的盐酸的质量为10克,现在共生成5.5克二氧化碳,参加反应的盐酸的质量为50克.故答案为:50
(4)设20克盐酸中溶质的质量为y
Na2CO3+2HCl=2NaCl+CO2↑+H2O
73 44
y 2.2g
=73 y 44 2.2g
y=3.65g
所用盐酸中溶质的质量分数=
×100%=18.25%3.65g 20g
第Ⅲ组反应后的溶液中含氯化氢的质量=10g×18.25%=1.825g
设和盐酸反应生成的氯化银的质量为z
HCl+AgNO3═AgCl↓+HNO3
36.5143.5
1.825g z
=36.5 1.825g 143.5 z
z=7.175g
和氯化钠反应生成的氯化银的质量=57.4g-7.175g=50.225g
设氯化钠的总质量为a
NaCl+AgNO3═AgCl↓+NaNO3
58.5143.5
a 50.225g
=58.5 a 143.5 50.225g
a=20.475g
设反应生成的氯化钠的质量为b
Na2CO3+2HCl=2NaCl+CO2↑+H2O
117 44
b 5.5g
=117 b 44 5.5g
b=14.625g
碱性调味液中氯化钠的质量=20.475g-14.625g=5.85g
碱性调味液中氯化钠的质量分数=
×100%%=5.85%5.85g 100g
因而该计算结果不对,该计算结果为20.5%,根据上述计算可知,把碳酸钠与盐酸反应生成的氯化钠的质量没有减去时算出的结果是20.5%.
故答案为:不正确.把碳酸钠与盐酸反应生成的氯化钠的质量没有减去
(或把碳酸钠与盐酸反应生成的氯化钠的质量也计算进去了)
