某校研究性学习小组进行了一个有趣的实验探究:
【提出问题】实验室有一瓶久置的NaOH,变质程度怎样?
【设计方案】先称取26.5g的NaOH样品(杂质为Na2CO3),配成溶液,样品全部溶解.然后向溶液中逐滴加入一定质量分数的稀盐酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数.
【进行实验】实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.
【数据处理】
(1)反应产生二氧化碳气体的质量为______g.
(2)该样品中Na2CO3的质量为多少?
(3)该样品中NaOH的质量分数为多少?
【反思与交流】从图中0~A点说明:在NaOH与Na2CO3的混合溶液中,加入强酸,首先反应的物质是______.
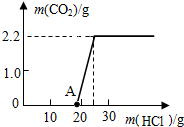
由图象可知,在检验样品中的杂质时加入稀硫酸,并无二氧化碳气体产生,原因是在碱性溶液中,盐酸与碱发生中和反应,不产生气体,当加入的盐酸的质量为10多克时,盐酸开始与样品中的碳酸钠发生反应,生成二氧化碳气体,并随着反应的进行,当继续滴加盐酸时,产生的气体为2.2g,并且不再变化,说明样品中的碳酸钠完全反应完毕,由此可根据二氧化碳的质量计算出样品的碳酸钠的质量,同些也可计算出原样品中氢氧化钠的质量,从而得出样品中氢氧化钠的质量分数.过程如下:
[数据处理](1)从图中得知:产生CO2的最大量为2.2g.
(2)设该样品中Na2CO3的质量为x,则:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10644
x2.2g
=106 x 44 2.2
x=5.3g
(3)则样品中NaOH质量分数为:
×100%=80%26.5g-5.3g 26.5g
【反思与交流】由图象可知开始加入硫酸时无气体生成,则一定是盐酸先与氢氧化钠反应,当氢氧化钠反应完后盐酸会再与碳酸钠反应生成二氧化碳;
故答案为:【数据处理】(1)2.2;(2)样品中Na2CO3的质量为5.3g;(3)NaOH的质量分数为80%.
【反思交流】NaOH;
