问题
计算题
把12g含少量铜屑的铁粉样品放到盛有100g 稀盐酸的烧杯中,恰好完全反应后,烧杯中物质的总质量为111.6g,求:
⑴铁粉样品中铁的质量分数。
⑵反应后所得溶液中溶质的质量分数。
答案
(1)93.3% (2)22.9%
(1)氢气的质量为100g+12g-111.6g=0.4g,
则设样品中铁的质量为x,生成氯化亚铁的质量为y,
Fe+2HCl═FeCl2+H2↑
56 127 2
x y 0.4g
56: x ="2" :0.4g ,127: y ="2" :0.4g
解得x=11.2g,y=25.4g
铁粉样品中铁的质量分数为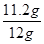 ×100%=93.3%,
×100%=93.3%,
答:铁粉样品中铁的质量分数为93.3%;
(2)反应后溶液的质量为111.6g-(12g-11.2g)=110.8g,
反应后所得溶液中溶质的质量分数为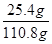 ×100%=22.9%,
×100%=22.9%,
答:反应后所得溶液中溶质的质量分数为22.9%.
点评:本题考查学生利用化学反应方程式的计算,明确氢气的质量是解答本题的关键,学生应熟悉金属与酸的反应、熟悉质量分数的计算.
