将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应。
此时烧杯内各物质的总质量为64.9 g。试计算:
(1)原混合物中铁粉的质量分数。(1分)
(2)反应后所得溶液中溶质的质量分数。(保留一位小数)(2分)
分析:根据金属的活动性顺序铁>氢>铜,混合物中铁与稀盐酸反应放出氢气而使反应后烧杯内各物质的总质量小于反应前各物质质量和,因此,利用质量守恒定律可求得恰好完全反应后放出氢气的质量;根据反应的化学方程式,由放出氢气质量计算参加反应的铁的质量及反应后生成氯化亚铁的质量,由反应后烧杯内各物质的总质量及混合物中不参加反应的铜的质量求得反应后溶液质量,即可完成计算.
解析:
根据质量守恒定律,恰好完全反应放出氢气的质量=7g+58.1g-64.9g=0.2g
设混合物中铁的质量为x,反应生成氯化亚铁的质量为y
Fe+2HCl═FeCl2+H2↑
56 127 2
x y 0.2g
56: x =127: y =2: 0.2g
x=5.6g,y=12.7g
(1)原混合物中铁粉的质量分数=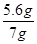 ×100%=80%
×100%=80%
(2)反应后所得溶液中溶质的质量分数=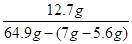 ×100%=20%
×100%=20%
答:(1)原混合物中铁粉的质量分数为80%;
(2)反应后所得溶液中溶质的质量分数为20%.
点评:利用质量守恒定律,确定恰好完全反应后放出氢气的质量是解答问题有基础,也体现了分析问题的能力.
