(7分)实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某敞口放置一段时间的盐酸的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)
测定溶液的pH,得到的数据如下:
| 加入氢氧化钠 的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
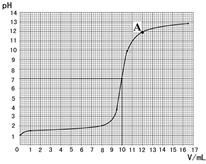
化钠溶液体积(V)之间的变化关系图。
(3)根据上图查出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积为 mL,A点所表示的溶液中溶质的化学式为 。
(4)计算此瓶盐酸的溶质质量分数。(请写出计算过程。氢氧化钠溶液的密度按1.0g/mL计算)
(1)8g 192 mL(2分)
(3)10.0mL(1分)NaOH NaCl (1分)

答:此瓶盐酸的溶质质量分数是3.65%。
分析:根据溶质的质量分数的计算公式可求出氢氧化钠和水的质量,当pH=7时,两者恰好完全反应,利用图象可此时参加反应的氢氧化钠溶液的体积;然后利用化学方程式的计算可求出参加反应的盐酸中氯化氢的质量,从而计算出其溶质的质量分数.
解答:解:(1)需要氢氧化钠固体的质量为:200g×4%=8g,则需要水的质量为:200g-8g=192g,合192ml.
(3)从烧杯中溶液的pH与加入氢氧化钠溶液体积(V)之间的变化关系图可以看出,当pH=7时,所滴加氢氧化钠溶液的体积为10ml时,A点加入氢氧化钠溶液体积是12ml,此时氢氧化钠剩余,溶液显碱性,故此时溶液中含的溶质为NaOH和NaCl.
(4)10ml氢氧化钠溶液的质量为10g,含氢氧化钠的质量为:10g×4%=0.4g.
 故答案为:(1)8g;192mL
故答案为:(1)8g;192mL
(3)10.0mL;NaOH;NaCl;
(4)设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
0.4g 10gx
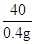 =
=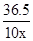
x=3.65%
答:此瓶盐酸的溶质质量分数是3.65%.
