问题
推断题
(3分)
现将71.9g高锰酸钾与二氧化锰的混合物充分加热,冷却后称得剩余固体的质量为65.5g。
请计算:
(1)生成氧气多少克?
(2)反应后剩余固体中钾、锰两种元素的质量比
答案
(1)6.4克
(2)156:275
(1)生成氧气的质量为:71.9g--65.5g=6.4g………(1分)
加热 |
 316 32
316 32
x 6.4g
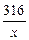 =
= 
x="63.2g" …………………………………………(1分)
反应前固体混合物中:钾元素的质量=63.2g× =15.6g
=15.6g
锰元素的质量=63.2g×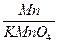 +(71.9g-63.2g)×
+(71.9g-63.2g)× =27.5g
=27.5g
据质量守恒定律,反应前后钾、锰元素的质量不变,故反应后固体混合物中,钾、锰元素的质量比为156:275 ……………………(1分)
