近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、碱性的(NH3-NH4Cl)以及传统的(HCl-FeCl3)等3种.蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失.几种蚀刻废液的常用处理方法如下:
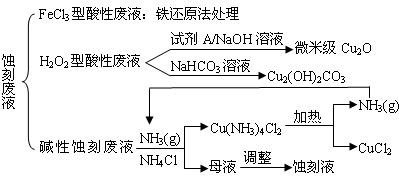
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生.发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有______、______.(用离子方程式表示).
(2)HCl-H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:______.
(3)H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的______(填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
(4)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是______.
(5)碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3•H2O+O2=2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是______.
(1)FeCl3型酸性废液中含有Fe3+和Fe2+,Fe3+具有氧化性,可与Fe反应,离子方程式为Fe+2Fe3+=3Fe2+,Fe2+具有还原性,可与Cl2反应,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2Fe3+=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-;
(2)H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,反应的化学方程式为Cu+2HCl+H2O2=CuCl2+2H2O,
故答案为:Cu+2HCl+H2O2=CuCl2+2H2O;
(3)HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O,选项中葡萄糖和甲醛都可,但葡萄糖资源广,无害,最合适,故答案为:③;
(4)当温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗,
故答案为:温度高会使产物部分分解产生黑色的氧化铜导致产品颜色发暗;
(5)Cu2+易与NH3发生反应生成配合物Cu(NH3)4Cl2,促使溶液中Cu(NH3)4Cl2结晶析出,故答案为:促使溶液中Cu(NH3)4Cl2结晶析出.
