问题
计算题
取12.4g碳酸铜(CuCO3,式量124)粉末放入盛有92g稀硫酸的烧杯中,恰好完全反应,生产的CO2气体全部逸出。请计算:
(1)反应生产H2O的质量。
(2)反应后烧杯中硫酸铜(式量160)溶液溶质的质量分数。
答案

分析:碳酸铜和硫酸反应,生成硫酸铜、水和二氧化碳,两物质恰好完全反应时,所得溶液为硫酸铜溶液;
根据反应的化学方程式,利用参加反应的碳酸铜的质量,可计算反应中生成水的质量、反应生成硫酸铜的质量;
反应后烧杯中硫酸铜溶液溶质的质量分数=  ×100%,反应后溶液质量可利用质量守恒定律求得.
×100%,反应后溶液质量可利用质量守恒定律求得.
解:设反应生成水的质量为x,生成硫酸铜的质量为y,生成气体二氧化碳的质量为z
CuCO3+H2SO4=CuSO4+CO2↑+H2O
124 160 44 18
12.4g y z x
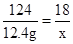
x=1.8g
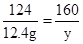
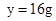
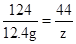 z=4.4g
z=4.4g
反应后硫酸铜溶液质量=12.4g+92g-4.4g=100.0g
硫酸铜溶液的溶质质量分数=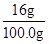 ×100%=16%
×100%=16%
答:(1)反应生产H2O的质量为1.8g;
(2)反应后烧杯中硫酸铜(式量160)溶液溶质的质量分数为16%.
