)某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0 g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0 g |
| 剩余固体的质量 | 1.5g | 1.0g | 0.5g | 0.3g | 0.3g |
(1)2.0g石灰石样品中碳酸钙的质量为 ,石灰石中碳酸钙的质量分数为 。
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数)。
:(1)1.7g 85% .......................(2分)
(2)设反应生成CaCl2的质量为x,CO2的质量为y 。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
1.7g x y .......................(1分)

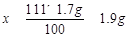 ..............................(1分)
..............................(1分)
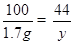
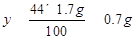 ..................................(1分)
..................................(1分)
反应后溶液的质量:1.7g+25g -0.7g =26g...............................(1分)
 ................................(1分)
................................(1分)
[若反应后溶液质量计算为:1.7g+25g=26.7g,扣这一步的1分;CaCl2%=(1.9g÷26.7g)×100%
≈7.1%,这一步同样给1分。其它类似错误同样方法处理]
答:(1)石灰石样品中碳酸钙的质量分数为85%;(2)反应生成溶液中氯化钙的质量分数为7.3% 。
分析:(1)固体剩余的质量是杂质的质量,由杂质的质量可计算出石灰石中碳酸钙的质量,由碳酸钙的质量可计算出石灰石中碳酸钙的质量分数;
(2)由碳酸钙的质量可以根据化学方程式计算出生成氯化钙的质量和二氧化碳的质量,进而计算出生成溶液中氯化钙的质量分数.
解:(1)最后剩余的0.3克为杂质质量,所以石灰石中碳酸钙的质量为2g-0.3g=1.7g;
石灰石中碳酸钙的质量分数为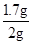 ×100%=85%.
×100%=85%.
(2)设生成CaCl2的质量为x,生成CO2的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
1.7g x y
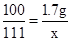
,x≈1.9g
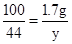
,y≈0.7g
生成溶液中氯化钙的质量分数为
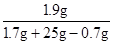 ×100%≈7.3%
×100%≈7.3%
答:(1)2.0g石灰石样品中碳酸钙的质量为1.7g,石灰石样品中碳酸钙的质量分数为85%;
(2)反应生成溶液中氯化钙的质量分数为7.3%.
