问题
填空题
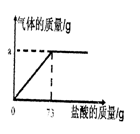
为了分析生铁中铁的含量,某学习小组进行了实验研究,即取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(如图)。说明:生铁中杂质不溶于水,不与盐酸、硫酸铜溶液反应。
(1)铁完全反应用去盐酸的质量为_______g。
(2)生铁中铁的质量分数为多少? (写出计算过程,结果保留到小数点后一位)
(3)某同学列出了如下计算式:
生铁与盐酸刚好反应完全时所得溶液质量=(73+6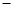 a)g
a)g
小明对该计算提出了质疑,请指出其中的错误______________________________.
答案

分析:(1)从图示可得盐酸的质量;
(2)根据铁与盐酸反应的化学方程式,已知所用盐酸的质量和质量分数,能够计算出生铁中铁的质量分数.
解答:解:(1)铁完全反应用去盐酸的质量从图示中可以看出是73克;
(2)73g盐酸中含有溶质的质量为:73g×10%=7.3g
设与盐酸反应的铁的质量为x.
Fe+2HCl═FeCl2+H2↑
56 73
x 7.3g
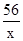 =
=
解得:x=5.6g
所以生铁中铁的质量分数为:
 ×100%≈93.3%
×100%≈93.3%
答:生铁中铁的质量分数为93.3%.
