问题
计算题
“黄铜”是铜锌合金,具有较好机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0 g某种黄铜投入100 g某稀硫酸中,恰好完全反应后剩余的溶液和残余固体总质量为119.8 g.请计算:
(1)产生氢气的质量为____g.
(2)这种黄铜中铜的质量分数是多少?
(3)剩余溶液中溶质的质量分数是多少?(结果精确到0.1%)
答案
析:(1)根据质量守恒定律可以知道,用黄铜和稀硫酸的质量和减去剩余溶液和残余固体总质量就是生成气体的质量.
(2)由气体的质量根据锌与硫酸反应的化学方程式可以计算出黄铜中锌的质量,进而求得铜的质量分数.
(3)由气体的质量根据锌与硫酸反应的化学方程式可以计算出生成硫酸锌的质量,进而计算出本题答案.
解答:解:(1)根据质量守恒定律可以知道,产生氢气的质量为:20.0g+100g-119.8g=0.2g
(2)设参加反应的锌的质量为x,生成的硫酸锌的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
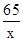 =
=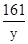 =
=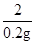
x=6.5g,y=16.1g
黄铜中铜的质量分数为: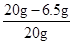 ×100%=67.5%
×100%=67.5%
剩余溶液中硫酸锌的质量分数为: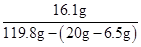 ×100%=15.1%
×100%=15.1%
答:(1)产生氢气的质量为0.2g.
(2)黄铜中铜的质量分数为67.5%;
(3)剩余溶液中硫酸锌的质量分数为15.1%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
