某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量(杂质不溶于水也不溶于酸),同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:

(1)原混合物中碳酸钙的含量;
(2)反应后所得溶液中溶质的质量分数。
(1)10g
(2)15%
分析:(1)因为碳酸钙和盐酸反应后会产生二氧化碳气体,所以烧杯中物质总质量会减少,根据质量守恒定律可知,烧杯中物质总质量的减少量就是生成的二氧化碳的质量,根据化学方程式利用二氧化碳的质量可得到碳酸钙的质量;
(2)根据碳酸钙和盐酸反应的化学方程式,利用二氧化碳的质量可求出生成的氯化钙的质量,进而求出氯化钙的质量分数,其中反应后溶液的质量=参加反应的固体质量+液体质量-生成的沉淀质量-生成的气体质量.
解答:解:(1)通过图象可知,反应产生的二氧化碳的质量为:84.4g-80g=4.4g
设原混合物中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
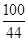 =
=
x=10g
(2)设反应产生的CaCl2的质量为y
 =
=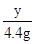
y=11.1g
反应后溶液质量=10g+68.4g-4.4g=74g
所以反应后CaCl2的质量分数为: ×100%=15%
×100%=15%
答:(1)原混合物中碳酸钙的含量是10g;
(2)反应后所得溶液中溶质的质量分数是15%.
点评:此题是和图象相结合的化学方程式的计算题,此题要分析清题意,看懂图象并利用图象中给出的数据来做题,另外要掌握质量分数的公式.
