如图所示,有人制作了一个家庭制氧装置。该制氧装置由2个饮料瓶、2根软管和药剂构成,整套装置成本不到3块钱。药剂包括过氧碳酸钠(2Na2CO3?3H2O2)和二氧化锰。制氧时,先在两个饮料瓶中加入适量的水,再往甲瓶中加入药剂,产生的气体通过B管从乙瓶导出,即可供人吸氧。
(1)为了顺利地导出甲瓶中产生的氧气,A软管在甲瓶中应_____________。
(选填“不伸入液面”或“伸入液面”)
(2)药剂加入水中后会发生以下两个反应:
2Na2CO3?3H2O2 =" 2Na2CO3+3H2O2" ;2H2O2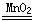 2H2O+O2↑
2H2O+O2↑
从化学反应的基本类型来看,它们都属于______________反应。
(3)已知总质量为110克的药剂可产生34克过氧化氢,则这包药剂完全反应会生成多少克氧气?
(1)不伸入液面(2)分解(3)设生成氧气的质量为x
2H2O2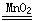 2H2O+O2↑
2H2O+O2↑
68 32
34g x
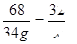
X=16g
答:略。
分析:(1)如果A软管在甲瓶中深入液面以下,就无法导出气体;
(2)先观察两个化学反应式的特点,再根据四种反应类型的定义判断;
(3)根据产生34克过氧化氢,和过氧化氢分解生成氧气的化学反应式,设生成氧气的质量为m计算即可.
解答:解:(1)如果A软管在甲瓶中深入液面以下,就无法导出气体.为了顺利地导出甲瓶中产生的氧气,A软管在甲瓶中应不伸人液面.故答案为:不伸人液面;
(2)根据化学反应式可知,这两种反应式都是由一种物质生成其他两种其他物质的分解反应.故答案为:分解;
(3)解:设可生成氧气质量为m
2H2O2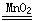 2H2O+O2↑
2H2O+O2↑
68 32
34g m
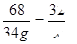
m=16g
答:可生成氧气质量为16g.
