现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)通过浮选、
焙烧使它转化为氧化锌,再把氧化锌和足量焦炭混合,在鼓风炉中加热至1373~1573K,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO ②
ZnO (s)+CO (g)  Zn (g)+CO2 (g) ③
Zn (g)+CO2 (g) ③
假设鼓风炉体积固定且密闭,随反应的进行鼓风炉内不同时间气态物质的物质的量浓度(mol/L)如下表
| 反应进行时间/min | CO | Zn | CO2 |
| 0 | 0.11 | 0 | 0 |
| 2 | 0.1 | 0.01 | 0.01 |
| 30 | c1 | c2 | c2 |
| 35 | c1 | c2 | c2 |
(2) 已知:该温度时,化学平衡常数K=1.0,则表中c1= (写出计算过程)
(3) 假设通过改变反应条件,若使焙烧炉中反应①的ZnO几乎完全被CO还原,焙烧炉和鼓风炉消耗的O2的体积比不超过 。
(4) 若起始浓度不变,通过改变反应条件,达平衡时鼓风炉中反应③CO的转化率为80%,此时该反应的平衡常数K= ,此时焙烧炉和鼓风炉消耗的O2的体积比大于
(1) 不变(1分);(2) 0.01 mol/L (3) 3:1 (4) 0.352 ;12:5或2.4
(1)对于确定可逆反应的平衡常数而言,只受温度的影响,故K不变。
(2) 由表中数据分析可知,反应③进行至30 min时,反应③达到平衡状态;故c1浓度为CO的平衡浓度。
设:从起始到平衡CO的浓度变化为x mol·L -1
ZnO (s)+CO (g)  Zn (g)+CO2 (g)
Zn (g)+CO2 (g)
起始: 0.11 0 0
变化: x x x
平衡: (0.11-x) x x
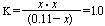 |
则该温度下反应的平衡常数
即:x2+x-0.11=0
(x+1.1)·(x-0.1)=0 x=0.1 mol·L -1
所以c1=0.01 mol·L -1
(3) ZnO几乎完全被CO还原的临界,将③视作完全进行的反应,②+③×2,得
鼓风炉中: 2ZnO (s)+2C+O2="2" Zn (g)+CO2 (g)。
焙烧炉中: 2ZnS+3O2=2ZnO+2SO2
故3:1是恰好被还原的理论值,超过则ZnS(ZnO )过量。
(4)解:设:从起始到平衡CO的浓度变化为x mol·L -1
ZnO (s)+CO (g)  Zn (g)+CO2 (g)
Zn (g)+CO2 (g)
起始: 0.11 0 0
变化: 0.088 0.0888 0.088
平衡: 0.022 0.088 0.088
K="(0.088×0.088)/0.22" =0.352
