(2011年湖北武汉,34题)实验室制取氧气所用的氯酸钾通常含一定量的杂质。小明同学称取6.00g样品与2.00g二氧化锰混合,加热使其完全反应,冷却至室温。将剩余固体与17.02g水充分溶解,过滤,得到的不饱和溶液中溶质的质量分数为14.9%。 若不考虑实验中药品的损耗,氯酸钾样品中的杂质不参与反应,也不溶于水。请回答下列问题。(结果精确到0.01g)
(1)要完全回收反应生成的氯化钾,还需进行的操作是________,可回收氯酸钾的质量为________;
(2)计算样品中氯酸钾的质量是多少?
(可能用到的相对原子质量:O-16Cl-35.
(1)蒸发(或蒸发水、蒸发溶剂、蒸发结晶) 2.98g
(2)解:设样品中氯酸钾的质量为x
2KClO3=2KCl+3O2↑
245 149
x 2.98g
245:149= x:2.98g x=4.90g
答:(略)
析:(1)根据结晶的两种方法进行分析;根据溶液中溶质的质量分数求出溶液中溶剂的质量分数,再根据  求出得到的溶液的质量,最后用溶液的质量×溶液中溶质的质量分数求出氯化钾的质量.
求出得到的溶液的质量,最后用溶液的质量×溶液中溶质的质量分数求出氯化钾的质量.
(2)利用氯酸钾制氧气的化学方程式,根据氯化钾的质量求出氯酸钾的质量.
解答:解:(1)结晶的方法有两种,冷却热饱和溶液和蒸发,要完全回收溶液中的溶质,只能用蒸发的方法.
得到的氯化钾溶液的质量=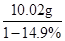 =20g 氯化钾的质量=20g×14.9%=2.98g
=20g 氯化钾的质量=20g×14.9%=2.98g
故答案为:蒸发 2.98g
(2)设氯酸钾的质量为x
2KClO9=2KCl+9O2↑
245 149
x 2.98g
245:149= x:2.98g x=4.90g
x=4.90g
答:氯酸钾的质量为4.90g
