问题
填空题
锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成
Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下
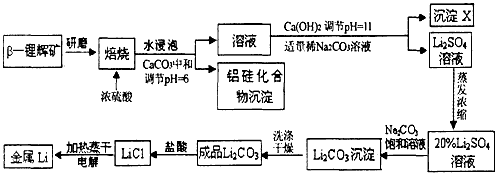
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因________________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:______________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是_____________________________。
答案
(1)Li2O·Al2O3·4SiO2
(2)CaCO3、Mg(OH)2
(3)前者是除去Ca2+,浓度过大会使部分Li+沉淀,后者是沉淀Li+,浓度大有利于Li2CO3沉淀的生成(其他合理答案均可)
(4)LiH+H2O==LiOH+H2↑
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解产成Li2O,电解时产生O2
