(8分)图1为某钾肥的包装标签,为检测K2SO4含量是否达标,进行如下实验:称取8.0g样品放入烧杯中,加水完全溶解后,再与足量氯化钡溶液充分反应,反应的化学方程式为:K2SO4 + BaCl2="==" BaSO4↓ + 2KCl(其他物质不参加反应)。沉淀质量与所加氯化钡溶液质量的关系如图2所示。根据条件完成下面两个问题:

(1)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?(写计算过程)
(2)两袋该钾肥实际所含钾元素的质量为 kg。(该空只写结果,保留整数)
(1)符合产品包装说明 (2)39
(1)根据图片可知硫酸钾与氯化钡反应生成沉淀BaSO4质量为9.32g,利用化学方程式即可计算出样品中硫酸钾的质量,进一步可以计算出样品中硫酸钾的质量分数,与标签注明含量进行比较。
(2)两袋该钾肥实际所含钾元素的质量为50kg×2×87%×(39×2)/174=39kg。
(1)解:由图可知,生成的BaSO4质量为9.32g
设8.0g钾肥样品中含有硫酸钠的质量为x,
K2SO4 + BaCl2=== BaSO4↓ + 2KCl
174 233………………………………………………(1分)
x 9.32g………………………………………………(1分)
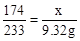 解得x=6.96g……………………………………………(2分)
解得x=6.96g……………………………………………(2分)
则样品中硫酸钾的质量分数为: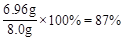 ………………………(1分)
………………………(1分)
由于87%>85%,该钾肥中硫酸钾的质量分数符合产品包装说明。…………(1分)
答:该钾肥中硫酸钾的质量分数符合产品包装说明。
(2)39………………………………………………………………………(2分)
