问题
计算题
(6) 已知碳酸钙在高温下可分解生成氧化钙和二氧化碳。同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:
| 反应时间∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
(1)当石灰石完全反应后,生成CO2的质量为 。
(2)求该石灰石中含CaCO3的质量分数(写出计算过程)。
答案
(1) 22g (2)62.5%
(1)由实验记录数据可知,在反应进行至t5时,继续煅烧剩余固体质量不再减小,说明碳酸钙已完全分解,根据质量守恒定律,生成二氧化碳的质量=80g-58g=22g,故答案为:22;
(2)解:设样品中含CaCO3的质量为x
CaCO3高温 CaO + CO2 ↑
100 44
x 22g
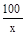 =
=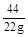 x=
x= =50g
=50g
样品中的质量分数=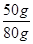 ×100%=62.5%
×100%=62.5%
答: 62.5%。。
