(4分)为测定一瓶久置的烧碱中氢氧化钠的含量,某同学取25.0 g样品,溶于水得到100g溶液,再加入100g足量稀硫酸,充分反应至不再产生气体,测得溶液质量为197.8g。
请计算:
(1)反应产生CO2的质量。
(2)样品中NaOH的质量分数。
(3)最后所得溶液中钠元素的质量。
(1)2.2g
(2)78.8%
(3)13.6g。
题目分析:(1)反应停止后,整个系统减少的质量就是反应释放的二氧化碳的质量,故CO2的质量 =" 100" g +100 g-197.8 g = 2.2g;
(2)要计算样品中氢氧化钠的质量分数,可以先计算出碳酸钠的质量,再计算氢氧化钠的质量。
解:设样品中碳酸钠的质量为x
Na2CO3+ H2SO4="==" Na2SO4 + H2O + CO2↑
106 44
x 2.2g
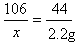
解得x=5.3 g
则样品中NaOH的质量为:25g-5.3 g ="19.7" g

(3)钠元素的质量就是氢氧化钠和碳酸钠中钠元素的质量之和。
即:所得溶液中钠元素的质量= 
答:(1)反应产生CO2的质量为2.2g。
(2)样品中NaOH的质量分数为78.8%。
(3)最后所得溶液中钠元素的质量为13.6g。
点评:注意分析,所得溶液中钠元素的质量就是氢氧化钠和碳酸钠中钠元素的质量之和。根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
