现有下列十种物质:
①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质中属于电解质有:______(用物质序号填空),可以利用⑦具有______现象这一简单物理方法区分⑦、⑧二种分散系.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为______.少量的④通入⑥的溶液中反应的离子方程式为______.
(3)17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为______,SO42-的物质的量浓度为______.
(4)②与⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,写出该反应的离子方程式并标出电子转移方向和数目:______.当有4.48升(标况)NO气体产生时,转移电子的物质的量为______,被还原HNO3 的质量为______克.
(1)在水溶液里或熔融状态下能导电的化合物是电解质,③CaO、⑤H2SO4、⑥Ba(OH)2、⑩Al2(SO4)3是电解质;⑧氨水、⑨稀硝酸、⑦红褐色的氢氧化铁液体是混合物,不是电解质也不是非电解质;④CO2 是非电解质;
①H2、②铝既不是电解质也不是非电解质.⑦红褐色的氢氧化铁液体是胶体能产生丁达尔效应.
故答案为:③⑤⑥⑩;丁达尔.
(2)H++OH-═H2O表示强酸和强碱的酸碱中和反应,且酸碱反应中只有水生成,强酸是硝酸,强碱是氢氧化钡,反应方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;少量二氧化碳和氢氧化钡反应生成碳酸钡和水,离子方程式为
Ba2++2OH-+CO2=BaCO3↓+H2O.
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;Ba2++2OH-+CO2=BaCO3↓+H2O.
(3)17.1gAl2(SO4)3的物质的量是
=0.05mol,所以硫酸根离子的个数=0.05mol×3NA=0.15NA;17.1g 342g/mol
C=
=0.6mol/L.0.05mol×3 0.25L
故答案为:0.15NA;0.6mol/L.
(4)强电解质写化学式,气体、弱电解质、金属单质写化学式,
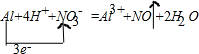
;
设转移电子的物质的量是x,被还原的硝酸根的物质的量是y.
Al+4H++NO3-=Al3++NO↑+2H2O转移电子
1mol 22.4L 3mol
y 4.48L x
所以x=0.6mol
y=0.2mol,被还原的硝酸根的物质的量等于被还原的硝酸的物质的量为0.2mol,所以被还原的硝酸的质量=0.2mol×63g/mol=12.6g,
故答案为:
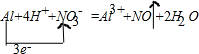
;0.6mol;12.6g.
