问题
计算题
某瓶装保健食品的外包装标签上的部分文字如下图。某同学为了测定该保健食品中CaCO3的质量分数,进行了如下实验:将100片该食品放入一烧杯中,再向其中注入120g(足量)的稀盐酸,直到不再产生气泡时,测得烧杯内剩余物质的总质量为150.2g。(注:该保健食品中其它成分不与盐酸反应)
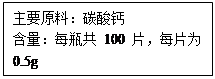
请你根据以上数据计算:
(1)反应生成气体(CO2)的质量为多少克?
(2)该保健食品中CaCO3的质量分数为多少?
答案
(1)19.8g (2)90%
题目分析:(1)根据质量守恒定律和由题中商标所给信息可知
反应生成气体(CO2)的质量为:0.5g×100+120g-150.2=19.8g;
设100片中含有碳酸钙的质量为X
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 19.8g
100/x=44/19.8 x=45g
该保健食品中CaCO3的质量分数为:45/50×100%=90%
