问题
计算题
(6分)氯酸钾和二氧化锰共热制取氧气,已知反应前混合物共15.5g,反应完全后剩余固体10.7g,问分解出氧气多少克?剩余固体混合物中二氧化锰多少克?(友情提示:化学方程式为2KClO3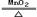 2 KCl + 3O2↑)
2 KCl + 3O2↑)
答案
4.8g,3.25g
题目分析:由于氯酸钾和二氧化锰共热会生成氧气,故反应前后固体质量差即为生成氧气的质量;再根据氧气的质量,利用化学方程式求出氯酸钾的质量,然后用反应前混合物的质量减去氯酸钾的质量,即可求出二氧化锰的质量。
解:设氯酸钾的质量为X
根据质量守恒定律可知,生成氧气的质量为15.5g-10.7g="4.8g"
2KClO3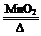 2KCl + 3O2↑
2KCl + 3O2↑
245 96
X 4.8g
245:96=X:4.8g
解得,X=12.25g
则二氧化锰质量为15.5g-12.25g="3.25g"
答:分解生成4.8g氧气,剩余固体混合物中二氧化锰为3.25g。
点评:此题是关于化学方程式的计算题,主要是利用反应方程式来分析和解决化学计算中的有关问题,要求学生要有较强的分析能力,解题的关键是要能结合质量守恒定律求出生成气体的质量,然后结合化学方程式进行计算即可;另外,要注意催化剂在化学反应过程中,其质量和性质都是不变的。
